13. لو كان محلول حمض الخل لوحده لكان تركيز أيون الخلات = تركيز أيون الهيدرونيوم ولكن نتيجة مزج المحلولين يرتفع كثيراً تركيز أيون الخلات ، مما يجعل المتفاعل في المعادلة السابقة يتجه إلى اليسار أي أن جزءاً من أيونات الهيدرونيوم يتحول إلى جزيئات حمض الخل وهذا معناه أن وجود أيون .......... أضعف تفكك حمض الخل أكثر .
14. ولكن 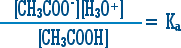
فيكون تركيز أيون الخلات = ص + 0.1 = 0.1 تقريباً لأن ص صغيرة جداً بالمقارنة مع 0.1 .
ويكون تركيز حمض الخل = 0.1 ـ ص = 0.1 تقريباً ص صغيرة جداً كما ذكرنا أعلاه .
إذن .....َ
1.8 × 10-5 = ص
إذن تركيز أيون الهيدرونيوم = 1.8 × 10-5 مول / لتر .
15. ولكن تركيز أيون الهيدرونيوم في محلول حمض الخل وهو منفرد كان = 1.35 × 10-3 مول / لتر وبعد المزج أصبح
1.8 × 10-5 مول / لتر .
أي أن التركيز انخفض بمقدار = 77 مرة عما كان عليه .
ملاحظة هامة : لقد افترضنا أننا حافظنا على تركيز حمض الخل وخلات الصوديوم ولم نغيره أي أبقيناه بعد المزج
0.1 مول / لتر لكليهما .
16. ما الذي سبب هذا الإنخفاض في تركيز أيون الهيدرونيوم ؟
ما الذي جعل تفكك حمض الخل أقل بكثير مما هو عليه ( كما كان في الوعاء 1)
17. كم درجة حموضة محلول حمض خل تركيزه 0.5 مول / لتر . (ثابت تفكك حمض الخل كما هو معطى أعلاه ).






 رد مع اقتباس
رد مع اقتباس













مواقع النشر (المفضلة)