التميه ( أو الإماهة ) Hydrolysis
تمهيد : حسب مفهوم أرينيوس " الأصلي " فإن الحمض مركب يدخل في تكوينه الهيدروجين ويجب أن يطلق أيون الهيدروجين في المحلول المائي ، فماذا عن المركبات والوحدات الكيميائية الأخرى التي تزيد تركيز الهيدروجين في المحلول المائي مع أن الهيدروجين لا يدخل في تركيبها .
مثال :
أو تلك التي يدخل الهيدروجين في تركيبها ولكنها أيونية .
مثال :
وماذا عن الوحدات الكيميائية التي ترفع تركيز أيون الهيدروكسيد ولا يدخل في تركيبها الهيدروكسيد نفسه .
مثال :
التميه أو الإماهة : لقد عرف أرينيوس هذه الحالات في زمانه ولذلك عالجها وأدخل مفهوماً جديداً هو مفهوم التميه ، وعرّفه على النحو التالي :
التميه أو الإماهة :
هو التفاعل بين أي ملح والماء بحيث ينتج عن هذا التفاعل زيادة في أيونات الهيدروجين أو في أيونات الهيدروكسيد .
مثال (1): ة
مثال (2):





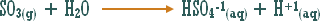
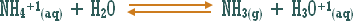
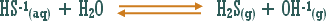
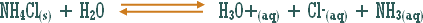
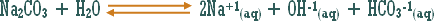
 رد مع اقتباس
رد مع اقتباس




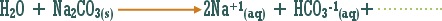
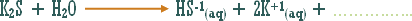
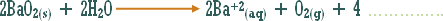
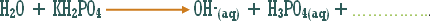
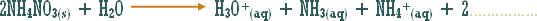
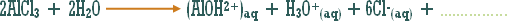
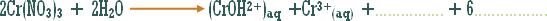
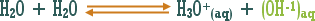
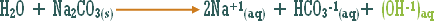
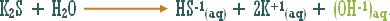
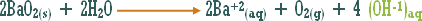
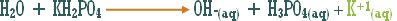

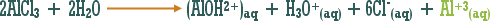
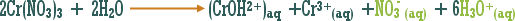

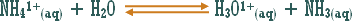

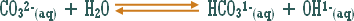
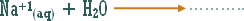
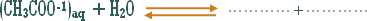
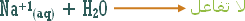
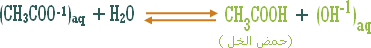

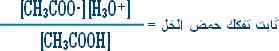
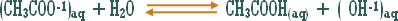
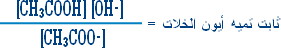

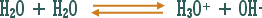
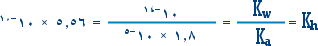
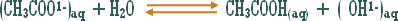
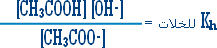
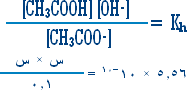
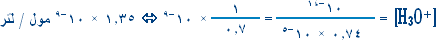
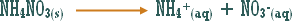
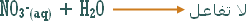
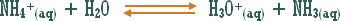





مواقع النشر (المفضلة)