7. إذا كان ثابت تميه الأمونيا ( ثابت تفكك القاعدة ) = 1.8×10-5 فاحسب ثابت تميه أيون NH4+ عند الدرجة 25 ْ م . Kw عند الدرجة 25 ْم = 10-14 .
الحل :
ثابت تميه أيون الأمونيوم
8. احسب درجة حموضة محلول لملح كلوريد الأمونيوم تركيز 0.5 مول / لتر .
تحليل السؤال :
ـ اكتب معادلة تميه كلوريد الأمونيوم الصلب .
ـ أيون الكلوريد Cl-(aq) يبقى سابحاً في المحلول أما أيون NH4+ فيتميه جزئياً في الماء حسب المعادلة :
ما ثابت تميه أيون NH4+؟
لقد حسبناه في السؤال السابق وهو = 5.56 × 10-10 .
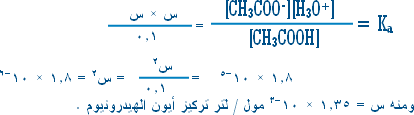
من المعادلة (I) أعلاه : كلما تميه جزيء من NH4+ كلما نتج جزيء من H3O+ وجزيء NH3 أي أن
[NH3] = [NH4+] = [ عدد جزيئات NH4+ المتميهة ]
لكن عدد جزيئات NH4+ المتميهة قليلة جداً بالمقارنة مع التركيز الابتدائي ( 0.2 مول / لتر ) فإذا فرضنا أن
عدد جزيئات NH4+ المتميهة = س جزيئة .
إذن تركيز NH4+ عند التوازن = [ 0.2 ـ س ]
= 0.2 تقريباً .
والآن بالعودة إلى معادلة (I):
س2 = 1.112 × 10-10 َ س= 1.05 × 10-5 مول / لتر .
لكن درجة حموضة المحلول (pH) = ـ لــو [H3O+]
= ـ لـو 1.05 × 10-5
= ـ لـو 10-5 ـ لـو 1.05
= ـ (-5) ـ 0.02
= 5 ـ 0.02 = 4.98 .





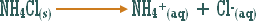

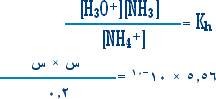
 رد مع اقتباس
رد مع اقتباس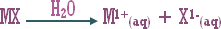
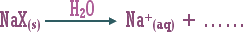
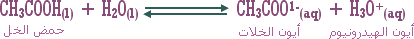



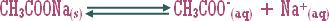


مواقع النشر (المفضلة)