مثال :
إذا كان لديك محلول حمض الاسيتيك CH3COOH تركيزه ( 0.1 مول / لتر ) أجب عما يلي:
1. احسب [H3O+] ( علماً بأن Ka =ه1.8 × 10-5 )
2. احسب pH للمحلول .
الحل :
1. لحساب قيمة [H3O+]
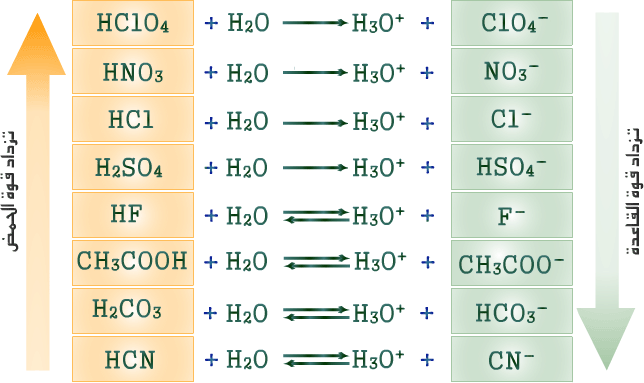
أ. نكتب معادلة التأين للحمض الضعيف
التركيز مول / لتر ( 0.1 )
صفر
صفر بداية التفاعل ( - س )
( + س )
( + س ) مقدار التغير ( 0.1 - س )
( س )
( س ) عند الاتزان
ب. بالتعويض في تعبير ثابت التأين Ka
إذاً :
1.8 × 10-5 × 0.1 = س2 وبأخذ الجذر التربيعي للطرفين
س = 1.3 × 10-3 مول / لتر
=ه1.3 × 10-3 مول / لتر
[H3O+]
وبالتالي
2. لحساب pH
1.3 × 10-3 = 2.88
[H3O+]
= لــو
pH







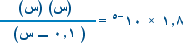
 رد مع اقتباس
رد مع اقتباس
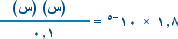





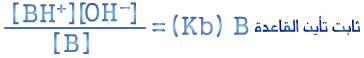


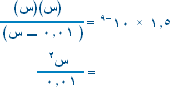
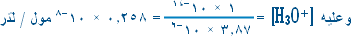



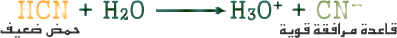






مواقع النشر (المفضلة)